W warunkach laboratoryjnych można skonstruować limfocyty, które będą rozpoznawały komórki rakowe i je niszczyły
Dr hab. med. Anna Wójcicka z Warszawskiego Uniwersytetu Medycznego i Warsaw Genomics
Czy możemy porozmawiać o terapiach genowych w onkologii?
– Ale takich jeszcze nie ma…
Jak to? A przeprogramowywanie limfocytów T w celu zwalczania raka? Ostatnio trochę o tym się mówi.
– Fakt, chociaż to nie jest klasyczna terapia genowa, która powinna polegać na tym, że naprawimy uszkodzenie genu, który doprowadził do powstania nowotworu. Ma pani na myśli tzw. terapię CAR-T, którą częściowo można nazwać genową, ale polega ona na tym, że uczulamy własne komórki odpornościowe, czyli limfocyty T, na nowotwór – po to, by go zniszczyć.
Proszę nam przybliżyć tę metodę.
– Zacznę od wyjaśnienia, czym jest nowotwór. To komórka naszego organizmu, która nagle zaczyna źle działać. Kompletnie nie słucha organizmu, dzieli się wtedy, kiedy nie powinna, i rośnie, kiedy nie trzeba. A zachowuje się dziwnie, dlatego że uszkodziła sobie geny, czyli wyłączyła instrukcję funkcjonowania.
Komórka uszkodziła sobie geny?
– Pierwszy etap nastąpił pod wpływem środowiska, np. nadmiernego promieniowania czy narażenia na dym tytoniowy. Najpierw uszkodzeniu ulega jeden gen, co powoduje łatwiejsze uszkodzenie następnego, a potem kolejnego itd. Jednym słowem, uruchamia się kaskada uszkodzeń. Taka komórka zachowuje się nietypowo, nie słucha już poleceń organizmu, że ma przestać się dzielić, ma też powyłączane możliwości naprawy uszkodzeń.
W ten sposób zaczyna się rozwijać rak?
– Tak to właśnie jest. Jeżeli mamy zmienione tylko pojedyncze komórki, wówczas nasz organizm za pomocą układu immunologicznego codziennie zabija takie komórki, aby się nie mnożyły i nam nie szkodziły. Ale niestety, jeśli dojdzie do wielu uszkodzeń, taka komórka staje się niewidoczna dla układu odpornościowego i nie może już być celem do zaatakowania. A właśnie podstawą terapii CAR-T jest spowodowanie, by komórki nowotworowe stały się widoczne dla naszego układu immunologicznego i by mógł on je zwalczać.
Jak to się robi?
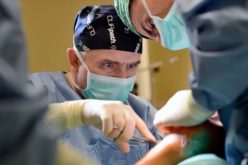
– Po prostu uczymy limfocyty T, czyli komórki odpornościowe, rozpoznawać komórki rakowe, właśnie te, które są mocno zmienione. Robi się to w warunkach laboratoryjnych. Najpierw pobiera się od pacjenta krew, w której są limfocyty, i zmienia się je w taki sposób, by potrafiły znaleźć i zniszczyć komórkę nowotworową. Kiedy podamy je ponownie pacjentowi do organizmu, będą u niego zwalczały raka.
Czy to jest metoda zwana immunoterapią?
– Tak, jest to odmiana immunoterapii i jedna z najnowocześniejszych metod leczenia raka. W warunkach laboratoryjnych można skonstruować niemal sztuczne limfocyty, które będą rozpoznawały komórki rakowe pacjenta, a potem je niszczyły.
To już jest wyższa szkoła jazdy. A w jakich nowotworach ma zastosowanie metoda CAR-T?
– Jest stosowana w białaczkach, nowotworach krwi. Natomiast nie umiemy jeszcze w ten sposób leczyć nowotworów litych, czyli guzów.
A czy jest dostępna w Polsce?
– Tak, istnieje możliwość zastosowania jej w białaczkach dziecięcych. Pamiętajmy jednak, że na świecie też jest to całkiem nowa metoda. W Stanach Zjednoczonych pierwsza terapia CAR-T została zatwierdzona przez Agencję Żywności i Leków (FDA) niespełna dwa lata temu. Jest dostępna i zatwierdzona także w niektórych nowotworach u młodych dorosłych.
Czy w ten sposób został wyleczony Jimmy Carter?
– Nie, w przypadku Jimmy’ego Cartera zastosowano immunoterapię klasyczną, która polega na czymś nieco innym. Pobudza się układ odpornościowy do walki z nowotworem za pomocą pewnych substancji, ale bez przeprogramowywania zachowania limfocytów. W metodzie klasycznej lek ma za zadanie pokazanie nowotworu układowi odpornościowemu. Bo komórki rakowe przykrywają się takimi cząsteczkami, które dla układu immunologicznego są jak czapka niewidka. I właśnie lek ją zdejmuje, sprawiając, że komórki rakowe znowu są widoczne i ich obecność pobudza układ odpornościowy do walki.
Klasyczna immunoterapia też jest dostępna w Polsce?
– Tak, mamy już kilka tego typu leków na rynku. Refundowana jest u nas np. w leczeniu czerniaka, raka jelita grubego czy nowotworu płuc.
Czyli można wyleczyć pacjentów z tych nowotworów?
– Oczywiście tak, choć niestety wciąż nie są to częste przypadki. A to dlatego, że pacjenci pojawiają się u lekarza za późno, kiedy nowotwór jest już w zaawansowanym stadium rozwoju. Chodzi więc często nie o to, by pacjenta całkowicie wyleczyć, ale o to, aby nowotwór przekształcić w chorobę przewlekłą. A to już bardzo wiele, bo pacjenci żyją z nim po kilkanaście lat i dłużej – jak np. z chorobą serca czy cukrzycą. Najważniejsze jest jednak to, że im wcześniej te choroby będą diagnozowane, tym większa jest szansa na ich skuteczne wyleczenie.
Jak można zastosować wiedzę z genetyki w terapiach przeciwnowotworowych?
– Tak jak wspominałam, nie umiemy jeszcze naprawiać uszkodzeń genetycznych w komórkach, ale za to potrafimy przeciwdziałać ich skutkom. Jak wiemy, gen jest instrukcją do zachowania się komórki i kiedy jest uszkodzony, komórka zaczyna np. nadmiernie się dzielić, powodując rozrost guza. W tej chwili potrafimy znaleźć rodzaj uszkodzenia genetycznego i opracować na tej podstawie lek, który będzie działał na skutki uszkodzenia. Ten rodzaj terapii nazywamy leczeniem celowanym.
Mamy już takie leki?
– Tak, jest ich niemało i pojawia się coraz więcej. Jednym z takich stosunkowo nowych leków jest Olaparib, który w Polsce jest już refundowany w terapii pacjentek z rakiem jajnika. Lek jest też skuteczny u osób z nowotworami piersi czy trzustki. Ale jest jeden warunek – tacy chorzy muszą mieć mutację w genie BRCA1 albo BRCA2, choć lista tych genów zapewne zostanie niebawem rozszerzona. W pozostałych przypadkach lek nie zadziała.
To rak piersi nie jest spowodowany tylko mutacją genów BRCA1 i BRCA2?
– Dotychczas udało nam się ustalić 14 genów odpowiedzialnych za ten nowotwór.
Jak można się dowiedzieć, czy dany lek będzie skuteczny?
– Zawsze przed rozpoczęciem leczenia trzeba przebadać tkankę nowotworową pod kątem mutacji genowej. I tylko w ten sposób można dopasować lek, który rzeczywiście zadziała. Bo on będzie działał na określone skutki wynikające z uszkodzenia konkretnego genu. To jest istotą terapii celowanej.
A co z chorymi, dla których nie ma takich leków? Chemioterapia, którą od lat się stosuje, nie cieszy się dobrą sławą. Pacjenci źle się czują, często muszą przerywać leczenie.
– Kiedy myślimy o chemioterapii, przychodzi nam do głowy, że każdy pacjent ma być leczony tak samo, czyli według z góry określonych schematów. A to nie tak powinno się odbywać. Każdy bowiem lek, nawet przeciwbólowy, inaczej działa na poszczególne osoby.
Ale jak to wcześniej sprawdzić?
– Zacznę od tego, że lek, który zażywamy, najpierw przechodzi przez naszą wątrobę, gdzie jest przekształcany, by lepiej działać, a potem musi być usunięty, aby nam nie szkodzić. I u niektórych osób wątroba niewydajnie usuwa chemioterapeutyk, prowadząc do jego nagromadzenia w organizmie, co wywołuje bardzo nasilone efekty toksyczne leczenia. Takim osobom nie powinno się podawać określonych rodzajów chemioterapii albo też zmniejszać dawki. Ale skąd mamy to wiedzieć?
No właśnie…
– Przed podaniem chemii możemy „przeczytać” strukturę konkretnych genów, które odpowiadają za usuwanie leku z organizmu, i na tej podstawie określić, jaką dawkę możemy zastosować u danej osoby: u kogo trzeba ją zredukować, a u kogo w ogóle zrezygnować z tego typu leczenia.
To chyba jakieś nowatorskie podejście?
– Zgadza się, to jest przełom. Podam przykład leku chemioterapeutycznego najczęściej stosowanego w raku jelita grubego i trzustki, który nazywa się 5-Fluorouracyl, a który potrafi dawać tak nasilone efekty toksyczne u niektórych pacjentów, że trzeba przerywać leczenie. A jest jeden gen, którego przebadanie powie nam, czy akurat ten pacjent może dostać standardową dawkę tego leku, czy w jego przypadku trzeba naprawdę uważać.
Doskonałe rozwiązanie!
– Niestety, nie wszyscy o tym wiedzą. A przecież dobrze byłoby wiedzieć wcześniej, jak dany pacjent zareaguje na określone leczenie, a nie przerywać je po pięciu-sześciu cyklach chemioterapii.
Kto się zajmuje takimi badaniami w Polsce? Państwo, czyli spółka Warsaw Genomics, która działa przy Uniwersytecie Warszawskim?
– Tak, my się tym zajmujemy. Ale to jest trudna sprawa. W terapiach celowanych sprawa jest jasna – pacjent może otrzymać dany lek wyłącznie po badaniu genetycznym, które podpowie, czy lek będzie skuteczny. W przypadku badań pod kątem chemioterapii jest inaczej: z jednej strony te badania można już wykonać w Polsce – robimy je w Warszawie, a także w Białymstoku, nawet część z nich można by było objąć refundacją NFZ dla pacjentów onkologicznych, ale z drugiej strony medycyna jest tak ubrana w procedury i schematy, że czasem trudno jest onkologowi wziąć pod uwagę wynik badania genetycznego, by zmienić leczenie – bo to nie jest jeszcze objęte żadną procedurą. Zdrowy rozsądek podpowiada, że warto zrobić badania genetyczne przed podaniem chemioterapii, ale rzeczywistość może być taka, że najbezpieczniejsze dla lekarza może się okazać postępowanie zgodne z procedurami, które nie zakładają zmian w leczeniu. Oczywiście to też się zmienia. Za część badań pacjenci też muszą sami płacić, co nie ułatwia lekarzowi przekazywania informacji, że warto takie badanie wykonać.
To już nie jest optymistyczne… Ale zapytam, czym jeszcze zajmuje się pani zespół?
– Zajmujemy się tym, co można wyczytać z genów. A jest to coraz więcej rzeczy. Przychodzą do nas ludzie, którzy proszą, aby ich przebadać od strony genetycznej, sprawdzić, czy mają większe ryzyko zachorowania na raka. Sprawdzamy wtedy, czy nie urodzili się z uszkodzeniem genu, które zwiększa ryzyko zachorowania na określony nowotwór. Przychodzą też osoby, w rodzinie których ktoś miał raka – bo chcą sprawdzić, co ich może czekać. Warto bowiem wiedzieć, że jeśli w rodzinie krąży uszkodzony gen, mamy 50% szans, że go odziedziczymy. A wraz z nim zwiększone ryzyko choroby. Takie osoby na pewno powinny wiedzieć, czy mają te mutacje. Bo jeśli tak, muszą wcześniej przeprowadzić różne badania. Jeśli ktoś np. ma uszkodzony gen odpowiadający za wystąpienie raka jelita grubego, musi po prostu wcześniej zrobić kolonoskopię: w wieku 25 lat, a nie czekać do pięćdziesiątki. Bo jak wcześniej się zgłosi, to ten nowotwór można będzie i szybciej wykryć, i lepiej wyleczyć.
Chciałam panią zapytać o postęp w terapiach nowotworowych za 10-15 lat. Co będzie nam mogła zaoferować genetyka, nad czym już się pracuje?
– Trudne pytanie, bo jest to dziedzina, która się rozwija nieprawdopodobnie szybko. A jednocześnie nadal mamy dużo zagadek. Chociaż dokładny zapis wszystkich genów człowieka rozszyfrowaliśmy w 2003 r., w dalszym ciągu o większości z nich nic nie wiemy. Absolutnie nic. Wiemy tylko, że są.
Okazało się, że tych genów jest mniej, niż zakładano.
– Tak, to wszystko prawda, a na dodatek z jakimikolwiek chorobami czy cechami połączyliśmy dotąd jakąś jedną piątą z nich. Znaczenia pozostałych genów nie znamy, nie wiemy też do końca, po co jest cała ogromna część naszego DNA. Natomiast jeżeli chodzi o nowotwory, to uszkodzenia genetyczne, które prowadzą do ich powstania, są stosunkowo dobrze scharakteryzowane. Myślę, że postęp będzie polegał na tym, że zanim zaczniemy leczyć pacjenta z nowotworem, wcześniej zbadamy go od strony genetycznej. Sądzę, że zaczną się rozwijać terapie ukierunkowane na leczenie konkretnego pacjenta. Właściwie już wiemy, że nie ma czegoś takiego jak nowotwór jelita grubego. U każdego pacjenta ten nowotwór ma troszkę inne podłoże i będzie inaczej przebiegał. W związku z tym wszystko idzie coraz bardziej w tę stronę, by leczyć konkretnego człowieka i jego problem, a nie statystyczną osobę ze statystyczną chorobą. I tak się na pewno będzie działo… Tylko pytanie, co z kosztami takiej terapii, bo one są, jak na razie, bardzo wysokie. Czym innym jest bowiem wyprodukowanie leku dla kilku milionów pacjentów, a czymś innym tylko dla danej osoby. Ale mimo to myślę, że wszystko pójdzie dobrze i to leczenie stanie się dostępne z czasem dla wszystkich. Musi. Nie mamy innej drogi.
Fot. Fotolia















Odpowiedz na treść artykułu lub innych komentarzy