Zabił, zamiast uśmierzyć ból
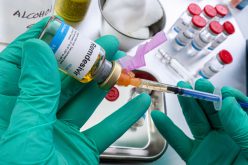
Tragiczne testy kliniczne nowego leku – Nie przypominam sobie drugiego takiego wypadku – mówiła w klinice w Rennes zdruzgotana Marisol Touraine, minister zdrowia Francji. Do tego szpitala trafiło z ciężkimi powikłaniami sześciu mężczyzn, którzy kilka dni wcześniej w ramach badań klinicznych I fazy przyjęli eksperymentalny lek przeciwbólowy. W badaniu przeprowadzanym przez firmę Biotrial na zlecenie portugalskiego koncernu farmaceutycznego Bial wzięło udział 90 zdrowych mężczyzn między 28. a 49. rokiem życia. Jeden z nich zmarł, trzem grożą nieodwracalne uszkodzenia mózgu. Sprawę wyjaśnia francuskie Ministerstwo Zdrowia, śledztwo prowadzi też prokuratura. Podobny przypadek zdarzył się w marcu 2006 r. w Wielkiej Brytanii. Tam również sześciu uczestników badań klinicznych I fazy trafiło do szpitala z niewydolnością wielonarządową. Wtedy jednak nikt nie umarł. Testowali lek, który miał modyfikować układ immunologiczny w terapii przewlekłej białaczki limfatycznej i reumatoidalnego zapalenia stawów. Chodziło o słynny TGN1412 firmy TeGenero. Badań coraz mniej Badania kliniczne na ludziach to końcowe etapy długiej i kosztownej drogi od stworzenia nowej substancji leczniczej do wprowadzenia jej na rynek. Najpierw jest euforia wynalazców i nadzieja chorych skutecznie rozbudzana przez media. Potem jednak mija wiele lat, zanim wynalazek trafi do aptek. Pierwszym krokiem w tym kierunku są doświadczenia na zwierzętach – myszach, szczurach, psach, kotach, świniach i szympansach. Kiedy kończą się one sukcesem, zaczyna się sprawdzanie preparatu na ludziach. W tej chwili w Polsce przeprowadza się ok. 400 badań klinicznych rocznie, znacznie mniej niż np. w Anglii, Francji, Niemczech, Czechach czy na Węgrzech. Od kilku lat liczba badań maleje – jeszcze w 2011 r. wykonywano ich 495, w 2012 r. – 448, w 2013 r. – 422, a w 2014 r. – tylko 396. Ten spadek tłumaczony jest wprowadzeniem przepisów unijnych i ciągle jeszcze niedostosowaniem firm badawczych do europejskich wysokich standardów, zwłaszcza w zakresie dokumentacji. Teresa Brodniewicz, prezes Stowarzyszenia na rzecz Dobrej Praktyki Badań Klinicznych w Polsce, wskazuje, że polskie firmy nie podają np. KRS, nie są w stanie przedstawić oryginału dokumentu założycielskiego itd. Rocznie w badaniach klinicznych w Polsce bierze udział 30-40 tys. osób. Każda zostaje wcześniej dokładnie przebadana i pouczona o tym, że świadomie zgadza się na eksperyment wiążący się z ryzykiem i że ma prawo wycofać się z badań na każdym etapie, bez żadnych konsekwencji. Ekspertka w zakresie prawa medycznego i farmaceutycznego mec. Ewa Rutkowska z Kancelarii Prawnej Kieszkowska Rutkowska Kolasiński podkreśla, że takie wyjaśnienie jest bardzo ważne, zanim uczestnik badań podpisze świadomą zgodę. Podpisanie takiego dokumentu oznacza bowiem, że zdaje sobie sprawę z ryzyka. Czy wypadki podczas badań klinicznych, choć nieliczne, świadczą, że przepisy w tej materii są niedoskonałe? Prawnicy twierdzą, że nie, przepisy są dobre. Jednak według mec. Rutkowskiej, nigdy w 100% nie ochronią one ludzi, bo w badaniach klinicznych ryzyka nie da się wykluczyć. OIOM w pobliżu Badania kliniczne składają się z czterech etapów. – Badania I fazy, czyli takie, w których lek podawany jest po raz pierwszy człowiekowi, wykonywane są w Polsce stosunkowo rzadko – mówi dr hab. n. med. Marek Czarkowski, przewodniczący Komisji Bioetycznej przy Okręgowej Izbie Lekarskiej w Warszawie. – Najczęściej wykonuje się u nas badania II, III, a także IV fazy. W 2015 r. dr Czarkowski nie opiniował żadnego badania I fazy. Wcześniej, owszem, odrzucił projekt takiego badania, ale ze względu na to, że na terenie, gdzie miał się odbyć eksperyment medyczny, nie było oddziału ratunkowego. A jest on niezbędny, bo może zaistnieć potrzeba udzielenia natychmiastowej pomocy. Ten wymóg nie został ujęty w oficjalnym prawie, ale niektóre komisje bioetyczne traktują go jako swój standard. Dr Czarkowski przypomina, że właśnie w 2006 r. w Londynie, gdy eksperymentowano z TGN1412, uczestnicy badania nie ponieśli jeszcze poważniejszych szkód zdrowotnych tylko dlatego, że z ich ośrodkiem sąsiadował OIOM i można było szybko udzielić im pomocy. W ich wypadku doszło do wstrząsu cytokinowego – gwałtownej i zagrażającej życiu reakcji organizmu na wprowadzoną substancję. Natomiast w sposobie prowadzenia badań nie doszukano się żadnych błędów. Niebezpieczna I faza Celem badań I fazy jest wykazanie, że lek nie szkodzi ludziom, czyli jest bezpieczny. W tym
Udostępnij:
- Kliknij, aby udostępnić na Facebooku (Otwiera się w nowym oknie) Facebook
- Kliknij, aby udostępnić na X (Otwiera się w nowym oknie) X
- Kliknij, aby udostępnić na X (Otwiera się w nowym oknie) X
- Kliknij, aby udostępnić na Telegramie (Otwiera się w nowym oknie) Telegram
- Kliknij, aby udostępnić na WhatsApp (Otwiera się w nowym oknie) WhatsApp
- Kliknij, aby wysłać odnośnik e-mailem do znajomego (Otwiera się w nowym oknie) E-mail
- Kliknij by wydrukować (Otwiera się w nowym oknie) Drukuj
Aby uzyskać dostęp, należy zakupić jeden z dostępnych pakietów:
Dostęp na 1 miesiąc do archiwum Przeglądu lub Dostęp na 12 miesięcy do archiwum Przeglądu
Porównaj dostępne pakiety