Już w grudniu w USA może się pojawić pierwszy, powszechnie dostępny lek na COVID-19
Rok temu opisaliśmy na łamach PRZEGLĄDU rywalizację koncernów farmaceutycznych pracujących nad szczepionką przeciw COVID-19. Na czele stawki była wówczas AstraZeneca współpracująca z zespołem naukowców Uniwersytetu Oksfordzkiego. Po piętach deptały jej dwie amerykańskie firmy – Moderna z własną szczepionką oraz Pfizer z preparatem opracowanym przez niemiecką spółkę BioNTech. Wiosną dołączył koncern Johnson & Johnson ze szczepionką jednodawkową. W Europie i Stanach Zjednoczonych te cztery specyfiki stały się podstawowym orężem w walce z pandemią. Dziś celem branży farmaceutycznej jest wprowadzenie na rynek skutecznego leku na COVID-19, bo kolejne fale zachorowań pojawiają się nawet w krajach, w których odsetek zaszczepionych obywateli jest bardzo wysoki, takich jak Izrael czy Singapur. Zdarza się też, że organizm osoby zaszczepionej reaguje niedostatecznie, co prowadzi do przykrych konsekwencji. Dlatego potrzebny jest lek, który zapobiegałby konieczności hospitalizacji pacjentów będących w najwcześniejszych stadiach choroby.
Blisko, coraz bliżej…
Lekarze w bogatych krajach mają już do dyspozycji przeciwciała monoklonalne, które podawane są dożylnie w szpitalach i na ogół okazują się skuteczne. Lecz to za mało. By pokonać pandemię, potrzebne są też powszechnie dostępne i możliwie niedrogie leki.
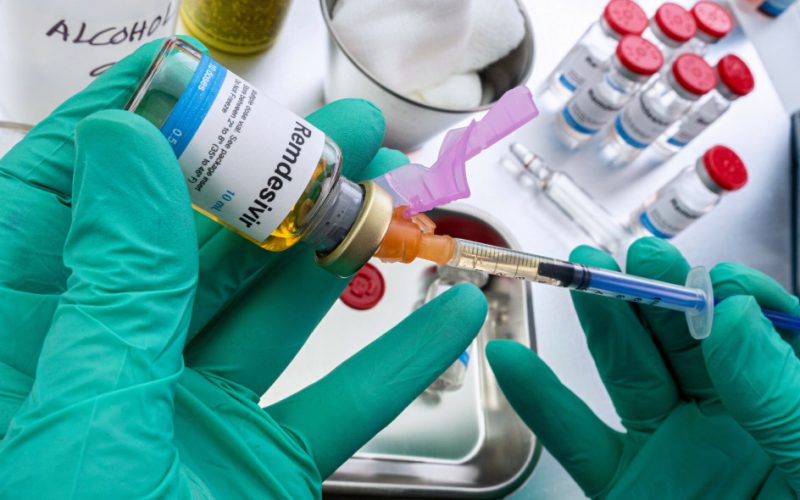
Amerykańskie media wymieniają dziś trzy koncerny, które są najbliżej uzyskania rejestracji swoich specyfików przez Agencję Żywności i Leków i wprowadzenia ich na rynek. To Merck & Co., Pfizer Inc. i F. Hoffmann-La Roche AG. Przy czym należy zaznaczyć, że już 22 października 2020 r. w Stanach Zjednoczonych został zatwierdzony do stosowania w warunkach szpitalnych pierwszy lek przeciw COVID-19, remdesivir, produkowany przez firmę Gilead Sciences Inc. Opracowano go z myślą o leczeniu eboli, lecz nie spełnił pokładanych w nim nadziei i nie uzyskał rejestracji. Rok temu okazało się, że może być skuteczny w leczeniu pacjentów z ciężkim przebiegiem COVID-19. Przyśpieszał ich powrót do zdrowia, choć nie wykazano, by zmniejszał liczbę zgonów. W połowie ubiegłego roku Europejska Agencja Leków zezwoliła na stosowanie remdesiviru na naszym kontynencie. Także polska Agencja Oceny Technologii Medycznych i Taryfikacji zaleca stosowanie go u pacjentów z potwierdzonym zakażeniem SARS-CoV-2 w okresie replikacji wirusa, czyli nie później niż pięć-siedem dni od wystąpienia pierwszych objawów choroby.
Pod kątem skuteczności w zwalczaniu SARS-CoV-2 badane były również inne stosowane już leki, co czasem prowadziło do poważnych kontrowersji. W czerwcu 2020 r. australijscy naukowcy ogłosili, że Iwermektyna – lek zwalczający choroby pasożytnicze u zwierząt i ludzi – we wstępnej fazie badań prowadzonych w warunkach laboratoryjnych znacznie osłabił oddziaływanie koronawirusa. Tyle wystarczyło, by zaczął być postrzegany jako cudowny lek na covid. Późniejsze badania tego nie potwierdziły, jednak Iwermektyna zyskała sporą popularność.
Podobnie rzecz się miała z amantadyną. Dziś i ten specyfik nie jest zalecany w leczeniu covidu.
Rywalizacja gigantów
Specyfikiem, który może wiele zmienić, jest molnupiravir, produkowany przez koncern Merck & Co. Jego historia zaczęła się, gdy mało kto na świecie zdawał sobie sprawę z zagrożenia, jakie niósł SARS-CoV-2. W styczniu 2020 r., w trakcie zorganizowanej w San Francisco konferencji poświęconej opiece zdrowotnej, dr George Painter – prezes Emory Institute for Drug Development z Atlanty, i Wendy Holman – dyrektor generalna spółki Ridgeback Biotherapeutics z Miami, dyskutowali o tym specyfiku, nad którym badania były kontynuowane dzięki finansowemu wsparciu z Narodowego Instytutu Zdrowia. Dr Painter uważał, że molnupiravir może się okazać skuteczny w leczeniu grypy, Wendy Holman była zaś ciekawa, czy nadaje się do zwalczania eboli. Oboje zgodzili się, że molnupiravir ma tak szerokie spektrum działania, że może być skuteczny przeciwko wielu chorobom. Ostatecznie w drugiej połowie marca 2020 r. firma Ridgeback Biotherapeutics zakupiła technologię produkcji molnupiraviru, a miesiąc później miała już umowę z farmaceutycznym gigantem, koncernem Merck & Co., który od lat zajmował się badaniami nad wirusami HIV i eboli. Pierwsza faza badań klinicznych ruszyła jesienią 2020 r. Dziś kończy się III faza badań i wkrótce koncern będzie dysponował opracowanymi wynikami. Jeśli uda się wykazać, że molnupiravir jest skuteczny i bezpieczny dla pacjentów, zostanie on zarejestrowany i trafi na rynek. Będzie to wielki sukces i szansa na kolejne odkrycia, które mogą uwolnić ludzkość od innych groźnych chorób wywoływanych przez wirusy.
Merck & Co. od lat jest światowym liderem w produkcji szczepionek i ma ogromne doświadczenie w ich produkcji. Jednak w roku ubiegłym nie udało mu się dotrzymać kroku konkurentom i musiał zrezygnować z kontynuowania prac nad własną szczepionką. Lek na COVID-19 to szansa, by wrócić na szczyt. Ale nie będzie to łatwe.
Według Biotechnology Innovation Organization, skupiającej firmy farmaceutyczne i biotechnologiczne, w różnych fazach znajdują się badania 246 substancji wykazujących działanie antywirusowe, z których część w przyszłości może zostać zarejestrowana jako leki.
27 września br. Pfizer ogłosił, że rozpoczął II/III fazę badań klinicznych, której celem jest ocena nowego kandydata na lek przeciwwirusowy, o nazwie PF-07321332. To inhibitor proteazy SARS-CoV-2 3CL, ma być podawany w połączeniu z niską dawką rytonawiru w celu zapobiegania zakażeniom wirusem wywołującym COVID-19. Badanie kliniczne obejmie 2660 zdrowych dorosłych uczestników, mieszkających w tych samych gospodarstwach domowych co osoby z potwierdzonym objawowym zakażeniem SARS-CoV-2. Pfizer, który jest już producentem szczepionki Comirnaty przeciw COVID-19, chce umocnić swoją pozycję, wprowadzając na rynek doustny lek powstrzymujący wirusa na wczesnym etapie. Zdaniem dr. Mikaela Dolstena, dyrektora naukowego odpowiedzialnego w koncernie za badania i rozwój leków, preparat byłby przepisywany przy pierwszych objawach infekcji, bez konieczności hospitalizacji pacjentów.
W kwietniu br. Pfizer ogłosił, że pracuje też nad substancją, która mogłaby się stać lekiem podawanym dożylnie pacjentom poważniej chorym na covid. Nazwano ją PF-07304814. Gdyby i te badania zakończyły się sukcesem, amerykański koncern dysponowałby pełną gamą preparatów przeciw covidowi, poczynając od szczepionki, poprzez lek doustny podawany we wczesnej fazie choroby, po lek dożylny, który byłby stosowany w cięższych przypadkach.
W rywalizacji koncernów liczy się też szwajcarski gigant Hoffmann-La Roche, który w październiku 2020 r. ogłosił nawiązanie współpracy z amerykańską firmą Atea Pharmaceuticals. Jej celem było opracowanie doustnej terapii dla pacjentów chorych na covid. Związek AT-527 działa poprzez blokowanie enzymu polimerazy RNA niezbędnego do replikacji wirusa. Rok temu był w II fazie badań klinicznych. Brali w niej udział hospitalizowani pacjenci z umiarkowaną postacią COVID-19. Prowadzone w różnych krajach badanie kliniczne III fazy z udziałem pacjentów poza szpitalem miało się rozpocząć w I kwartale 2021 r. 29 kwietnia br. Roche podpisał umowę z naszą Agencją Badań Medycznych, na mocy której w maju koncern miał uruchomić rekrutację pacjentów do II i III fazy badań klinicznych AT-527.
30 czerwca br. Atea Pharmaceuticals poinformowała, że analiza wyników 62 hospitalizowanych pacjentów, którym podano AT-527, wykazała, że substancja jest bezpieczna i dobrze tolerowana przez organizm człowieka. Przy czym wykazuje silną aktywność przeciwwirusową, która przejawia się hamowaniem replikacji SARS-CoV-2, co może prowadzić do szybszego powrotu do zdrowia, minimalizując jednocześnie przenoszenie infekcji. Czas pokaże, czy AT-527 przejdzie proces rejestracji w amerykańskiej Agencji Żywności i Leków oraz Europejskiej Agencji Leków i trafi na apteczne półki.
Azja robi swoje
Prace nad doustnym lekiem na covid trwają także w Japonii. Na razie jedynym dostępnym w tym kraju specyfikiem jest podawany hospitalizowanym pacjentom z łagodniejszymi objawami koktajl łączący dwa przeciwciała opracowany przez firmę Chugai Pharmaceutical.
27 lipca br. inna firma farmaceutyczna, Shinogi z Osaki, rozpoczęła I fazę badań klinicznych nad substancją podawaną doustnie pacjentom z lekkimi objawami. W badaniach miało uczestniczyć 75 osób dorosłych w wieku od 20 do 55 lat. W III fazie badań klinicznych znajduje się avigan, tabletka przeciwwirusowa Fujifilm Holdings.
Ostatnio zaskoczył ekspertów chiński koncern Sinopharm, który 12 września br. ogłosił, że pracuje nad pierwszym na świecie lekiem na COVID-19 opartym na ludzkiej immunoglobulinie pochodzącej z osocza ozdrowieńców. Czyżby Chińczycy poszli drogą wyznaczoną przez polską spółkę Biomed Lublin? Być może nie wiedzą, że dotychczasowe doświadczenia wskazują, że tego rodzaju substancje mogą być stosowane jedynie w początkowej fazie infekcji, a spodziewane korzyści są bardzo ograniczone.
Kiedy będzie można kupić w aptece pigułkę na COVID-19? W Stanach Zjednoczonych – jeśli zostanie zarejestrowana i dopuszczona do obrotu – być może pod koniec tego roku. W Europie pewnie później. Skuteczny lek pozwoliłby odciążyć szpitale, gdyż znaczna grupa chorych mogłaby bez ryzyka zostać w domach. Inną, kto wie, czy nie większą korzyścią, będzie zdobycie kolejnych doświadczeń, które zaowocują skuteczniejszymi lekami przeciwwirusowymi.
W ostatnich 20 miesiącach w światowej biotechnologii i farmacji dokonał się niezwykły postęp. Wiemy, że w ciągu dziewięciu-dziesięciu miesięcy koncerny farmaceutyczne są w stanie wyprodukować od podstaw skuteczną szczepionkę przeciw niebezpiecznemu wirusowi. A to znaczy, że jeśli zostaną zapewnione odpowiednie środki, można sobie poradzić z innymi groźnymi chorobami.
Ta uwaga nie dotyczy Polski. Choć, przypomnę, rząd premiera Morawieckiego miał wiosną plany budowy fabryki szczepionek nad Wisłą. I ich rozlewni w Polfie Tarchomin. Warto sobie uświadomić, że pod tym względem nasz przemysł i świat nauki nie nadaje się nawet do popychania karuzeli.
m.czarkowski@tygodnikprzeglad.pl
Fot. East News
















Odpowiedz na treść artykułu lub innych komentarzy